Avance en enfermedades de las plantas: una nueva enzima podría conducir a pesticidas antibacterianos
Las enfermedades de las plantas plantean desafíos importantes para la productividad agrícola y presentan obstáculos formidables que requieren atención urgente. Si no se controlan, estas enfermedades pueden propagarse rápidamente, causando daños generalizados a los cultivos y provocando rendimientos reducidos y pérdidas económicas sustanciales. Por lo tanto, es fundamental identificar con precisión los patógenos responsables de estas enfermedades. Esta identificación permite intervenciones específicas que minimizan los riesgos y mitigan eficazmente los impactos agrícolas.
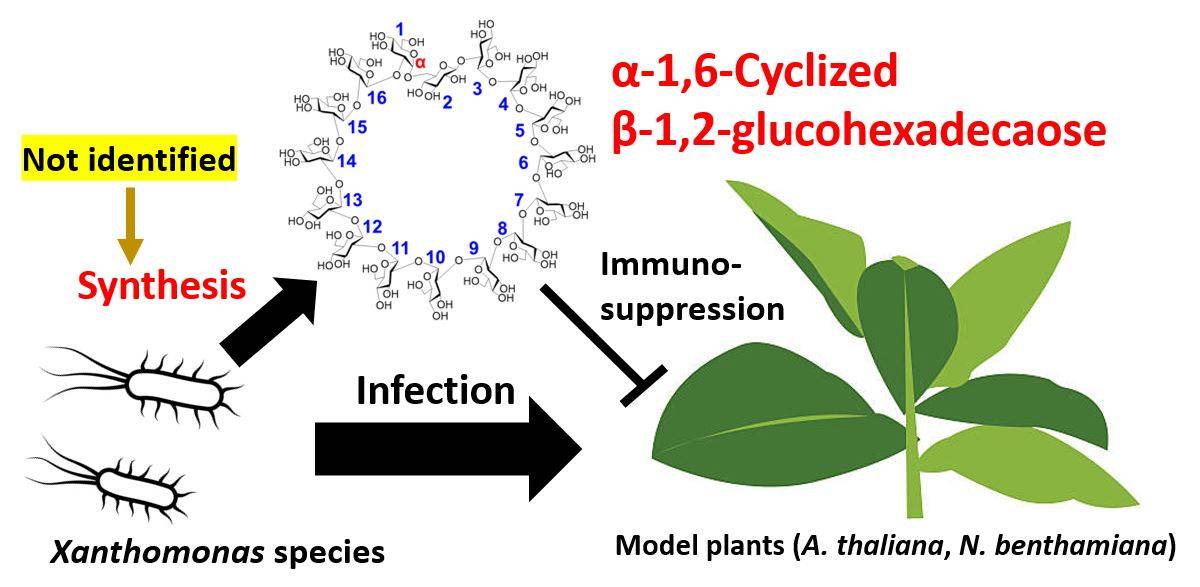
Xanthomonas Las especies son patógenos vegetales notorios que afectan a un amplio espectro de huéspedes, incluidos cultivos clave como arroz, trigo y tomates. Estos patógenos aumentan su patogenicidad mediante la utilización de β-1,2-glucohexadecaosa α-1,6-ciclada (CβG16α) para suprimir los mecanismos de defensa esenciales de las plantas, como la expresión de proteínas relacionadas con la patogénesis y la acumulación de callosa.
En un avance reciente publicado el 19 de junio de 2024, en el Revista de la Sociedad Química Estadounidense, un equipo de investigadores dirigido por el profesor asociado Masahiro Nakajima de la Universidad de Ciencias de Tokio reveló un descubrimiento importante. Identificaron XccOpgD, una glucósido hidrolasa (GH186) que se encuentra en X. campestris pv campestris que juega un papel fundamental en la biosíntesis de CβG16α. El equipo de investigación también incluyó al Sr. Sei Motouchi de la Universidad de Ciencias de Tokio, el científico principal Shiro Komba del Instituto de Investigación Alimentaria, NARO, y Hiroyuki Nakai de la Universidad de Niigata.
“Las estructuras de glicanos son intrincadas y multifacéticas y cumplen diversas funciones cruciales en la naturaleza y los organismos. Las enzimas sintetizan y degradan glicanos, exhibiendo diversas estructuras y funciones que corresponden a la diversidad de glicanos. Sin embargo, nuestro conocimiento de estas enzimas es todavía limitado, lo que impulsa la búsqueda de nuevas enzimas con potenciales nuevos y variados”, explica el profesor Nakajima, explicando la justificación del estudio.
El equipo realizó análisis bioquímicos para dilucidar el papel de XccOpgD en la biosíntesis de CβG16α. Se emplearon técnicas avanzadas como la cristalografía de rayos X como análisis estructural para desentrañar el mecanismo catalítico de la enzima y la especificidad del sustrato.
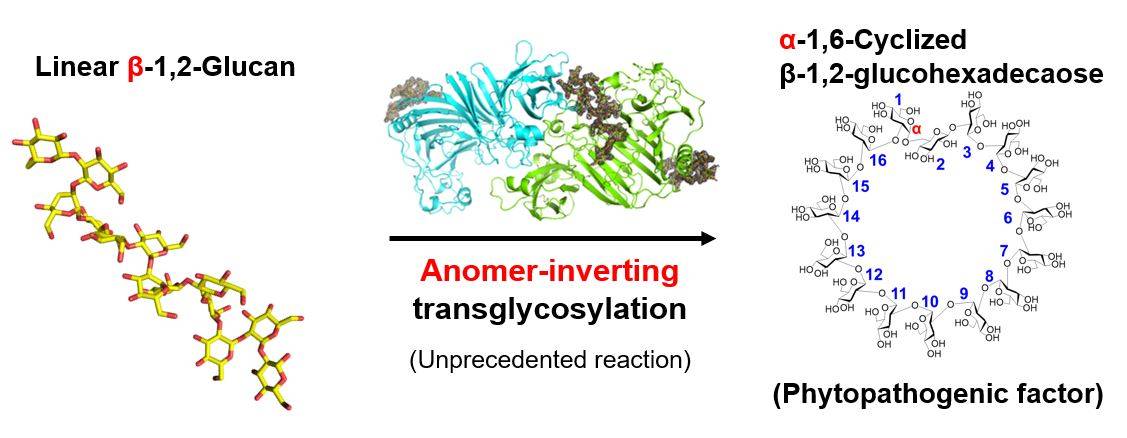
Estos esfuerzos han producido conocimientos profundos. XccOpgD pertenece a la familia GH186, esencial para regular los componentes de la pared celular bacteriana. A diferencia de las primeras enzimas GH186 identificadas, XccOpgD exhibe un mecanismo enzimático sin precedentes conocido como transglicosilación inversora de anómero.
Los científicos identificaron el compuesto cíclico como CβG16α. Crédito de la imagen: Masahiro Nakajima de la Universidad de Ciencias de Tokio.
“Las reacciones de las enzimas GH típicas se clasifican en cuatro tipos mediante combinación de retención o inversión y reacción con agua (hidrólisis) o azúcar (transglicosilación) en teoría. Sin embargo, de alguna manera falta una clasificación en una larga historia de investigaciones sobre enzimas asociadas a carbohidratos y descubrimos la clasificación que falta. Este avance fue posible gracias a un entorno estructural único, que abre nuevas posibilidades para la glicosilación basada en enzimas”, explica el profesor Nakajima. Además, las cadenas de azúcar sintetizadas mediante este mecanismo no son simplemente componentes menores sino estructuras esenciales utilizadas por diversas bacterias Gram-negativas en la naturaleza con fines patógenos.
Estudios detallados revelaron que el β-1,2-glucano lineal se convirtió en un compuesto cíclico y el compuesto se identificó como CβG16α mediante resonancia magnética nuclear. El análisis estructural del complejo de Michaelis identificó residuos de unión al sustrato cruciales, lo que dilucida aún más interacciones específicas a lo largo de la cadena de glucano. En particular, XccOpgD utiliza un mecanismo de transglicosilación inversora de anómero, en el que D379 y D291 desempeñan funciones fundamentales como catalizadores.
Estos hallazgos profundizan nuestra comprensión y abren vías para desarrollar estrategias específicas contra las enfermedades de las plantas inducidas por Xanthomonas. “Esperamos en el futuro un concepto de pesticida dirigido a este homólogo de enzima. A diferencia de los fungicidas que promueven la aparición de bacterias resistentes a los medicamentos en el suelo, atacar esta enzima podría potencialmente inhibir la patogenicidad sin causar esterilización. Los homólogos de enzimas identificados en este estudio pueden servir como dianas farmacológicas prometedoras basadas en estructuras, ofreciendo una posible solución al problema de las bacterias resistentes a los medicamentos”, afirma esperanzado el profesor Nakajima.
El descubrimiento de XccOpgD y su papel en la biosíntesis de CβG16α marca un gran avance en la agricultura. Promete una mayor resiliencia y seguridad alimentaria al tiempo que mitiga los impactos ambientales relacionados con los pesticidas convencionales. En general, este avance ofrece soluciones sostenibles a los desafíos agrícolas globales, promoviendo la gestión ambiental y la viabilidad económica para los agricultores de todo el mundo.